Il est 7h du matin. Vous vous levez et vous prenez votre petit déjeuner. Comme des milliers d'autres français vous avez peut-être l'habitude de prendre un verre de jus d'orange. Le jus d'orange est le jus le plus consommé par les français, il est surtout bu au petit déjeuner. Mais ce n'est pas seulement en France que l'on trouve une consommation importante de ce jus. Cette boisson fraîche et acide se boit tous les jours partout dans le monde. La consommation mondiale de jus d'orange s’élève à 55.000.000.000 litres par an!
Le jus d'orange est une source riche en minéraux et vitamines, notamment en vitamine C. Nous buvons ce jus aussi pour répondre à notre besoin quotidien de vitamine C. Mais: est-ce que la quantité de vitamine C dans un jus reste stable, ou change-t-elle en fonction des différentes conditions qu'on lui applique dans la vie quotidienne? À travers cette problématique nous allons étudier des facteurs différents qui s'appliquent dans des situations réelles pour le jus d'orange. Nous espérons alors trouver le meilleur moyen de stocker le jus pour pouvoir exploiter de la meilleure façon ses vitamines
C.
*http://www.planetoscope.com/boisson/201-consommation-mondiale-de-jus-d-orange.html
La quantité de vitamine C dans un jus d'orange, change-t-elle en
fonction des différentes conditions qu'on lui applique dans la vie quotidienne?
L'importance de la vitamine C dans notre organisme.
Notre corps a besoin d'apports journaliers en vitamines, en effet il n'est pas capable de les synthétiser, ni de les stocker. C'est pour cela qu'elles sont apportées uniquement par l'alimentation, il est donc très important de consommer des aliments riches en vitamines.
La vitamine C est présente majoritairement dans les oranges, le kiwi, les agrumes et végétaux frais en général. Cette vitamine est très importante pour notre organisme, en effet, ses principaux rôles sont:
- Des effets stimulants: elle crée des actions stimulantes et tonifiantes du corps mais également anti-inflammatoires.
- La croissance: elle participe à la synthèse du collagène, protéine indispensable dans la réparation des tissus (peau, cartilage, os, ligaments, muscles, vaisseaux sanguins) mais aussi à l'assimilation et fixation du calcium nécessaire au maintien et à la croissance des os.
- La protection des cellules: elle participe au renforcement du système immunitaire en stimulant la synthèse d'anticorps et la prolifération de globules blancs, elle permet également de lutter contre le vieillissement des cellules grâce à son action anti-oxydante. (cette dernière étant très importante car la vitamine C s'oxyde plus rapidement que les molécules de nos cellules, elle agit donc comme une barrière contre l'oxydation de nos cellules)
Sources: http://www.nutrition-expertise.fr/vitamines/vitamine-c.html
http://www.nutrition-expertise.fr/vitamines/vitamine-c/293-allegations-efsa.html
www.caducee.net/Fiches-techniques/vitamineC-1.asp

La vitamine C est présente majoritairement dans les oranges, le kiwi, les agrumes et végétaux frais en général. Cette vitamine est très importante pour notre organisme, en effet, ses principaux rôles sont:
- Des effets stimulants: elle crée des actions stimulantes et tonifiantes du corps mais également anti-inflammatoires.
- La croissance: elle participe à la synthèse du collagène, protéine indispensable dans la réparation des tissus (peau, cartilage, os, ligaments, muscles, vaisseaux sanguins) mais aussi à l'assimilation et fixation du calcium nécessaire au maintien et à la croissance des os.
- La protection des cellules: elle participe au renforcement du système immunitaire en stimulant la synthèse d'anticorps et la prolifération de globules blancs, elle permet également de lutter contre le vieillissement des cellules grâce à son action anti-oxydante. (cette dernière étant très importante car la vitamine C s'oxyde plus rapidement que les molécules de nos cellules, elle agit donc comme une barrière contre l'oxydation de nos cellules)
Sources: http://www.nutrition-expertise.fr/vitamines/vitamine-c.html
http://www.nutrition-expertise.fr/vitamines/vitamine-c/293-allegations-efsa.html
www.caducee.net/Fiches-techniques/vitamineC-1.asp
Oda, Mathilde et Elva le matin avant de commencer les cours:
 |

L'acide ascorbique
La vitamine C (ou acide ascorbique) est un acide hydrosoluble, elle est très peu stockée et elle n'est pas produite par l'organisme. Celle-ci est soluble dans l'eau, stable à l'air sec et à la lumière que lorsqu'elle est sous forme cristalline, sinon elle est peu stable dans les autres cas. L'acide ascorbique est un acide faible c'est à dire qu'il réagit partiellement avec l'eau. Sa formule est C6H8O6.
Hypothèses sur l'évaluation de la quantité de vitamine C dans un jus d'orange
Pour
exploiter notre problématique nous allons étudier 4 facteurs différents
qui peuvent ou non avoir un impact sur la quantité de vitamine C dans un
jus d'orange. Ces facteurs sont:
- La présence de dioxygène.
- Le temps
- La température
- La lumière
Vidéo réalisée afin de montrer les hypothèses de nos camarades.
Après avoir écouté les hypothèses de nos camarades, nous nous sommes mises en accord sur nos propres hypothèses. Nous pensons que ces 4 facteurs peuvent avoir un effet destructeur pour la vitamine C. En revanche, en choisissant le facteur qui nous semble être le plus important, nous ne sommes pas toutes du même avis. Elva pense que la température est le facteur le plus destructif, Mathilde pense que c'est le temps et Oda pense que c'est la présence de dioxygène.
Le jus d'orange choisit pour nos expériences
Pour effectuer nos mesures de vitamine C dans le jus d'orange, nous avons choisi d'utiliser le jus d'orange 100% pur jus de la marque U. On a choisi ce jus parce que c'est un jus d'orange 100% pur jus sans sucres, colorants ou conservateurs ajoutés, comme on peut le lire sur la brique. On a choisi la marque U pour coopérer avec notre budget, car il nous fallait acheter un certain nombre de briques de jus pour faire toutes nos mesures. De plus nos déplacements étaient limités et le magasin U se situe à côté de notre lycée. Nous avons également fait le choix d'utiliser un jus d'orange en brique et non en bouteille transparente, pour mieux étudier l'effet de la lumière sur la vitamine C.
 |
| Photo de notre brique de jus d'orange choisie pour nos expériences |
 |
| Lettre de renseignements service client U |
- LE PETIT +
Nous avons contacté le service client U, afin de connaître plus précisément la composition de leurs briques de jus d'orange. Ils nous ont ensuite redirigé vers leur fabricant: Tetrapak. Nous avons pu leur demander de plus amples renseignements sur les matériaux qui composent cette brique. Par la suite, nous avons reçu ce courriel qui a confirmé nos hypothèses sur l'importance que jouent la lumière et l'oxygène sur la vitamine C.
Recherches menées auparavant sur la provenance des matériaux et leur disposition:
-Carton: transformation bois
-Polyéthylène: pétrole, film plastique → 4 couches intérieur et extérieur (étanchéité de l'emballage)
-Aluminium → face intérieur brique (protège de la lumière, de l'oxygène, des microbes + conserve goût et vitamines!)
Source: http://www.cc-bosceawy.fr/download/fiche2_il_etait_une_fois_la_brique_alimentaire.pdf
Recherches menées auparavant sur la provenance des matériaux et leur disposition:
-Carton: transformation bois
-Polyéthylène: pétrole, film plastique → 4 couches intérieur et extérieur (étanchéité de l'emballage)
-Aluminium → face intérieur brique (protège de la lumière, de l'oxygène, des microbes + conserve goût et vitamines!)
Source: http://www.cc-bosceawy.fr/download/fiche2_il_etait_une_fois_la_brique_alimentaire.pdf
Le jus d'orange sous différentes conditions
Pour exploiter notre problématique nous allons effectuer des expériences sur du jus d'orange mit sous différentes conditions. Voici nos expériences prévues:
- Est-ce que la vitamine C dans un jus d'orange diminue en présence de dioxygène?
Comparaison entre:
- Une brique fermée une semaine dans le réfrigérateur. (Température: 6,2°C*)
- Une brique ouverte une semaine dans le réfrigérateur. (Température: 6,2°C) - Est-ce que la vitamine C dans un jus d'orange diminue en fonction du temps qui passe?
Comparaison entre:
- Une brique fermée une semaine dans le réfrigérateur. (Température: 6,2°C)
- Une brique fermée quatre semaines dans le réfrigérateur. (Température: 6,2°C)
On a fait l'expérience de ce dernier jus quelques jours avant sa date d'expiration. - Est-ce que la température a une impact sur la quantité de vitamine C dans un jus d'orange? Comparaison entre:
- Une brique ouverte une semaine dans le réfrigérateur. (Température: 6,2°C)
- Une brique ouverte une semaine à l'air ambiante. (Température: 20,1°C**) - Est-ce que la lumière a un impact sur la quantité de vitamine C dans un jus d'orange?
Comparaison entre:
- Un verre laissé une semaine à coté de la fenêtre. (Température: 20,1°C)
- Une brique ouverte une semaine à l'air ambiante. (Température: 20,1°C)
*température relevée dans le frigidaire du laboratoire d'SVT.**température ambiante relevée dans le laboratoire d'SVT.
Le principe du dosage de l'acide ascorbique.
La vitamine C est aussi appelée acide ascorbique et a pour formule brute C6H8O6. Pour déterminer la concentration molaire de l'acide ascorbique nous allons faire un dosage à l'aide d'une réaction chimique entre l'acide ascorbique et une solution d'hydroxyde de sodium pour laquelle on connait déjà la concentration molaire (0,05 mol/L) et qui contient des ions OH-. Quand on fait réagir l'hydroxyde de sodium avec une solution diluée du jus d'orange, qui contient de l'acide ascorbique, la réaction chimique suivante se produit:
C6H8O6 + OH- → C6H8O6- + H2O
Notre expérience se fait en trois étapes. Premièrement on fait une dilution du jus d'orange avant de préparer un montage et enfin on réalise le dosage.
Source: http://machimelec.free.fr/FMB/TP_fichiers/CHIMIE-I/CI.b_ExAO_dosage-pHmetrique-vitamineC.pdf
La dilution
Voici une explication détaillée de la solution par dilution pour réaliser notre expérience du dosage de l'acide ascorbique
1) Verser la solution mère (ici le jus d'orange) dans un bêcher. Prélever 5,0 mL de solution à l'aide d'une pipette jaugée à un ou deux trait(s) de jauge, munie d'une propipette (ou poire aspirante) ou d'un pipeteur. Ajuster le ménisque au trait de jauge.
2) Introduire la solution prélevée dans une fiole jaugée de 50,0 mL
3) Remplir la fiole jaugée aux deux quarts avec de l'eau distillée.
4) Agiter pour homogénéiser la solution après l'avoir bouchée
5) Déboucher la solution. ajouter de l'eau distillée jusqu'au trait de jauge (ajuster le ménisque jusqu'au trait de jauge en faisant très attention).
6) Reboucher la fiole jaugée et la retourner plusieurs fois pour bien homogénéiser la solution.
 |
| dessins réalisés par nos soins afin d'expliquer la dilution |
1) Verser la solution mère (ici le jus d'orange) dans un bêcher. Prélever 5,0 mL de solution à l'aide d'une pipette jaugée à un ou deux trait(s) de jauge, munie d'une propipette (ou poire aspirante) ou d'un pipeteur. Ajuster le ménisque au trait de jauge.
2) Introduire la solution prélevée dans une fiole jaugée de 50,0 mL
3) Remplir la fiole jaugée aux deux quarts avec de l'eau distillée.
4) Agiter pour homogénéiser la solution après l'avoir bouchée
5) Déboucher la solution. ajouter de l'eau distillée jusqu'au trait de jauge (ajuster le ménisque jusqu'au trait de jauge en faisant très attention).
6) Reboucher la fiole jaugée et la retourner plusieurs fois pour bien homogénéiser la solution.
La préparation du montage
 |
| dessin d'une burette et de l'agitateur magnétique |
1) Rincer la burette avec de l'eau distillée, puis avec l'hydroxyde de sodium.
2) Remplir la burette d'hydroxyde de sodium et ajouter le niveau au zéro.
3) Verser la solution diluée (le jus d'orange) dans un bêcher propre.
4) Placer le bêcher sur l'agitateur magnétique, sous la burette, et y introduire le barreau aimanté.
Pour notre expérience il faut ensuite ajouter 2 gouttes de rouge de crésol dans la solution. Cela fait changer de couleur la solution qui devient rouge quand il ne reste plus d'acide ascorbique.
Expérience sur le dosage colorimétrique
Voici la vidéo qui permet de montrer l'expérience du dosage visuel que nous avons effectué. Lorsque notre solution prend une couleur rose/rouge, cela signifie qu'il n'y a plus de vitamine c dans notre solution
Les premiers résultats visuels du dosage colorimétrique
Dans un premier temps nous avons fait un dosage colorimétrique dans le but de trouver la quantité d'hydroxyde de sodium versée dans la solution au moment où elle devient rouge, c'est à dire au moment où il n'y a plus d'acide ascorbique dans la solution.
 |
| Comme nous pouvons voir sur la photo que nous avons prise, la solution est d'abord jaune |
 |
| La solution devient rouge quand il n'y a plus d'acide ascorbique. Tout a réagi avec l'hydroxyde de sodium comme nous pouvons voir sur la photo |
 |
| On regarde le chiffre indiqué sur la burette pour chaque jus. |
On a obtenu les résultats suivants pour le volume d'équivalence (=volume versé quand on obtient un changement de couleur) :
- Jus d'orange fermé 1 semaine au frigo (6,2°C) : 11,7 mL
- Jus d'orange ouvert 1 semaine au frigo (6,2°C) : 11,0 mL
Dosage pH-mètrique
Après avoir essayé de faire des mesures à l'œil nu, nous avons décidé de changer un peu notre expérience pour pouvoir obtenir des résultats plus exacts, à l'aide d'un pH-mètre. Nos résultats trouvés à l'aide de l'indicateur coloré ne sont pas très exacts car la couleur change lentement et nous n'arriverons pas forcement à retrouver systématiquement la même couleur. Avec le pH-mètre nous mesurons le pH de la solution chaque fois que l'on y ajoute de la soude. Par la suite, nous allons faire une courbe pour chaque solution de jus, avec les résultats obtenus, et grâce aux calculs trouver le point d'équivalence entre l'acide et la base.
Protocole:
1) Étalonner le pH-mètre à l'aide des solutions tampons: Régler le pH-mètre à un pH = 4 pour la solution connue d'un pH = 4 et à 7 pour la solution connue d'un pH = 7.
2) Préparer par dosage colorimétrique (voir post numéro 7) la solution de jus d'orange (=50mL).
3) Rincer la burette avec de l'eau distillée, puis avec l'hydroxyde de sodium.
4) Remplir la burette d'hydroxyde de sodium et ajuster le niveau au zéro.
5) Verser la solution diluée (le jus d'orange) dans un bêcher propre.
6) Placer le bêcher sur l'agitateur magnétique, sous la burette, et y introduire le barreau aimanté.
7) Introduire la sonde de mesure dans le bêcher.
8) Mettre l'agitation en marche.
9) Verser mL par mL le réactif (l'hydroxyde de sodium) dans le bêcher.
10) Noter dans un tableau le volume du réactif versé et le pH de la solution.
Protocole:
1) Étalonner le pH-mètre à l'aide des solutions tampons: Régler le pH-mètre à un pH = 4 pour la solution connue d'un pH = 4 et à 7 pour la solution connue d'un pH = 7.
2) Préparer par dosage colorimétrique (voir post numéro 7) la solution de jus d'orange (=50mL).
3) Rincer la burette avec de l'eau distillée, puis avec l'hydroxyde de sodium.
4) Remplir la burette d'hydroxyde de sodium et ajuster le niveau au zéro.
5) Verser la solution diluée (le jus d'orange) dans un bêcher propre.
6) Placer le bêcher sur l'agitateur magnétique, sous la burette, et y introduire le barreau aimanté.
7) Introduire la sonde de mesure dans le bêcher.
8) Mettre l'agitation en marche.
9) Verser mL par mL le réactif (l'hydroxyde de sodium) dans le bêcher.
10) Noter dans un tableau le volume du réactif versé et le pH de la solution.
 |
| Tableaux des résultats du pH en fonction du volume de soude versé |
Résultats du dosage pH-mètrique: graphiques
Voici les graphiques obtenus avec les résultats du pH-mètre. Nous avons utilisé la méthode des tangentes parallèles à la courbe (pH en fonction du volume de soude), ceci nous permettra de trouver par la suite le point d'équivalence de chacune de ces courbes.
 |
| Graphique du jus d'orange ouvert 1 semaine à l'air ambiant |
 |
| Graphique du jus d'orange fermé 4 semaines frigo |
 |
| Graphique du jus d'orange ouvert 1 semaine lumière air ambiant |
Le volume d'équivalence
Pour réaliser nos calculs afin de trouver la masse de l'acide ascorbique dans chaque jus d'orange nous avons besoin du volume d'équivalence se trouvant sur le point où la médiatrice des deux lignes parallèles et la courbe se croisent. Nous construisons une ligne parallèle à l'axe des ordonnées et passant par le point d'équivalence et l'axe des abscisses pour trouver le volume d'équivalence.
 |
| Graphique et tracé du point d'équivalence du jus d'orange ouvert 1 semaine frigo - Ve = volume d'équivalence |
 |
| Graphique et tracé du point d'équivalence du jus d'orange fermé 1 semaine frigo - Ve = volume d'équivalence |
 |
| Graphique et tracé du point d'équivalence du jus d'orange ouvert 1 semaine à l'air ambiant - Ve = volume d'équivalence |
 |
| Graphique et tracé du point d'équivalence du jus d'orange fermé 4 semaines frigo - Ve = volume d'équivalence |
 |
| Graphique et tracé du point d'équivalence du jus d'orange ouvert 1 semaine à l'air ambiant - Ve = volume d'équivalence |
Calcul pour trouver le valeur de Ve:
(Distance 0-Ve / Distance 0-2) x 2
Exemple: jus d'orange fermé 1 semaine à l'air ambiant:
[ 7,1 / ( 12,1 / 9 ) ] x 2 = 10,6 mL
Calcul de la masse d'acide ascorbique
Au point de l'équivalence on a autant de vitamine C (qui est acide) que d'hydroxyde de sodium (qui est basique). Calcul littéral:
nacide = nbase
CA x VA = CB x VB
CA = (CB x VB) / VA
CA = nbase / VA
CA = nacide / VA
nacide = macide / Macide
CA = mA / (MA x VA)
mA = CA x MA x VA
Avec CA =concentration molaire de la solution d'acide ascorbique dosée en mol/L
MA = masse molaire de l'acide ascorbique en g/mol = 176 g/mol
VA = volume de la solution d'acide ascorbique en mL = 5 mL
Avec CA =concentration molaire de la solution d'acide ascorbique dosée en mol/L
MA = masse molaire de l'acide ascorbique en g/mol = 176 g/mol
VA = volume de la solution d'acide ascorbique en mL = 5 mL
Pour trouver CA nous utilisons la partie CA = base / VA des calculs déjà détaillés.
CA = CB x VB / VA
Avec CB = concentration molaire de l'hydroxyde de sodium en mol/L = 0,05 mol/L
VB = volume d'hydroxyde de sodium versé à l'équivalence (le volume d'équivalence) en mL
VA = volume de la solution d'acide ascorbique en mL = 5 mL
Calcul numérique: jus d'orange ouvert 1 semaine au frigo. Pour celui-ci nous avons trouvé un volume d'équivalence de 11,9 mL. Nous avons alors:
CA = ( 0,05 x 11,9 ) / 5
CA = 1,19.10-1
Donc
mA = 1,19.10-1 x 176 x 5
mA = 104,72 mg
En faisant les mêmes calculs pour tous les jus dosés nous avons obtenus les résultats suivants:
Ouvert 1 semaine au frigo: 104,72 mg
Fermé 1 semaine au frigo: 117,92 mg
Ouvert 1 semaine à l'air ambiant: 107,36 mg
Fermé 4 semaines au frigo: 94,16 mg
Ouvert 1 semaine à l'air ambiant + lumière: 95,92 mg
CA = ( 0,05 x 11,9 ) / 5
CA = 1,19.10-1
Donc
mA = 1,19.10-1 x 176 x 5
mA = 104,72 mg
En faisant les mêmes calculs pour tous les jus dosés nous avons obtenus les résultats suivants:
Ouvert 1 semaine au frigo: 104,72 mg
Fermé 1 semaine au frigo: 117,92 mg
Ouvert 1 semaine à l'air ambiant: 107,36 mg
Fermé 4 semaines au frigo: 94,16 mg
Ouvert 1 semaine à l'air ambiant + lumière: 95,92 mg
Analyse des résultats
En regardant nos résultats nous allons essayer de répondre aux 4 questions posées au début:
1. Est-ce que la quantité de vitamine C dans un jus d'orange diminue en présence de dioxygène?
Fermé 1 semaine au frigo (6,2°C*): 117,92 mg
Ouvert 1 semaine au frigo (6,2°C): 104,72 mg
Différence: 13,2 mg
Selon nos expériences, la présence de dioxygène autour d'un jus d'orange peut détruire la vitamine C qu'il contient.
2. Est-ce que la quantité de vitamine C dans un jus d'orange diminue en fonction du temps qui passe?
Fermé 1 semaine au frigo (6,2°C): 117,92 mg
Fermé 4 semaines au frigo (6,2°C): 94,16 mg
Différence: 23,76 mg
Selon nos expériences, le temps qui passe détruit aussi la vitamine C dans le jus.L'action du facteur "temps" est donc encore plus importante que celle du dioxygène.
3. Est-ce que la température a un impact sur la quantité de vitamine C dans un jus d'orange?
Ouvert 1 semaine à l'air ambiant (20,1°C**): 107,36 mg
Ouvert 1 semaine au frigo (6,2°C): 104,72 mg
Différence: 2,64 mg
La différence entre ces deux briques de jus d'orange est peu importante, et nous remarquons même que le jus d'orange ouvert à température ambiante, contient le plus de vitamines C: le contraire de notre hypothèse.
On peut alors peut être déduire qu'une différence de température a un impact sur la quantité de vitamine C, mais il faudrait faire davantage d'expériences pour en être certains. Avec plus de temps ou une différence de température plus importante, l'écart entre ces deux briques de jus aurait été plus importante, mais pour l'instant nous ne pouvons pas le prouver avec certitude.
4. Est-ce que la lumière a un impact sur la quantité de vitamine C dans un jus d'orange?
Ouvert 1 semaine à l'air ambiant: 107,36 mg
Ouvert 1 semaine à l'air ambiant + lumière: 95,92 mg
Différence: 11,44 mg
Selon nos expériences, la lumière semble détruire la vitamine C dans le jus d'orange.
BILAN: La présence de dioxygène, le temps qui passe et la présence de lumière sont tous des facteurs qui semblent réduire le taux de vitamine C dans le jus d'orange. Selon nos mesures, le temps est le facteur le plus important. Il nous reste alors à décrire comment ces facteurs détruisent la vitamine C.
*température relevée dans le frigidaire du laboratoire d'SVT.**température ambiante relevée dans le laboratoire d'SVT.
1. Est-ce que la quantité de vitamine C dans un jus d'orange diminue en présence de dioxygène?
Fermé 1 semaine au frigo (6,2°C*): 117,92 mg
Ouvert 1 semaine au frigo (6,2°C): 104,72 mg
Différence: 13,2 mg
Selon nos expériences, la présence de dioxygène autour d'un jus d'orange peut détruire la vitamine C qu'il contient.
2. Est-ce que la quantité de vitamine C dans un jus d'orange diminue en fonction du temps qui passe?
Fermé 1 semaine au frigo (6,2°C): 117,92 mg
Fermé 4 semaines au frigo (6,2°C): 94,16 mg
Différence: 23,76 mg
Selon nos expériences, le temps qui passe détruit aussi la vitamine C dans le jus.L'action du facteur "temps" est donc encore plus importante que celle du dioxygène.
3. Est-ce que la température a un impact sur la quantité de vitamine C dans un jus d'orange?
Ouvert 1 semaine à l'air ambiant (20,1°C**): 107,36 mg
Ouvert 1 semaine au frigo (6,2°C): 104,72 mg
Différence: 2,64 mg
La différence entre ces deux briques de jus d'orange est peu importante, et nous remarquons même que le jus d'orange ouvert à température ambiante, contient le plus de vitamines C: le contraire de notre hypothèse.
On peut alors peut être déduire qu'une différence de température a un impact sur la quantité de vitamine C, mais il faudrait faire davantage d'expériences pour en être certains. Avec plus de temps ou une différence de température plus importante, l'écart entre ces deux briques de jus aurait été plus importante, mais pour l'instant nous ne pouvons pas le prouver avec certitude.
4. Est-ce que la lumière a un impact sur la quantité de vitamine C dans un jus d'orange?
Ouvert 1 semaine à l'air ambiant: 107,36 mg
Ouvert 1 semaine à l'air ambiant + lumière: 95,92 mg
Différence: 11,44 mg
Selon nos expériences, la lumière semble détruire la vitamine C dans le jus d'orange.
BILAN: La présence de dioxygène, le temps qui passe et la présence de lumière sont tous des facteurs qui semblent réduire le taux de vitamine C dans le jus d'orange. Selon nos mesures, le temps est le facteur le plus important. Il nous reste alors à décrire comment ces facteurs détruisent la vitamine C.
*température relevée dans le frigidaire du laboratoire d'SVT.**température ambiante relevée dans le laboratoire d'SVT.
Expérience témoin
Afin de pouvoir confirmer que nos analyses des résultats soient correctes, nous avons fait une expérience témoin en mesurant la quantité de vitamine C dans 2 briques différentes de jus d'orange juste après l'achat:
Comme nous pouvons le voir, la différence de la masse d'acide entre les deux solutions diluées est de 1,76 mg. Elle est très petite, ce qui nous confirme que les briques de jus d'orange que l'on a acheté contiennnent environ le même taux d'acide ascorbique, avant que l'on ne commence à leur appliquer des facteurs différents.
 |
| Graphique et trace du point d'équivalence pour un jus d'orange juste après l'achat |
 |
| Graphique et trace du point d'équivalence pour un deuxième jus d'orange juste après l'achat |
Premier jus d'orange : 11,8 mL soit 103,84 mg d'acide
Deuxième jus d'orange : 12,0 mL soit 105,60 mg d'acide
Différence : 1,76 mg
Comme nous pouvons le voir, la différence de la masse d'acide entre les deux solutions diluées est de 1,76 mg. Elle est très petite, ce qui nous confirme que les briques de jus d'orange que l'on a acheté contiennnent environ le même taux d'acide ascorbique, avant que l'on ne commence à leur appliquer des facteurs différents.
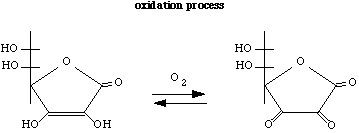
Oxydation de l'acide ascorbique
D'abord il y a une transformation du réducteur acide ascorbique à son oxydant, l'acide déhydroascorbique, et la perte de 2 électrons et 2 atomes d'hydrogène.
C6H8O6 (aq) --> CH6O6 (aq) + 2e- + 2H
Acide ascorbique (réduit) --> Acide déhydroascorbique (oxydé) + électrons + atomes d'hydrogène
Ensuite les atomes d'hydrogène vont venir réagir avec l'oxydant, le dioxygène le transformer en son réducteur, l'eau. (Pour créer un équilibre dans l'équation on a ajouté 2 atomes d'hydrogène).
O2 (g) + 4e- + 4H --> 2H2O (aq)
Dioxygène (oxydé) + électrons + atomes d'hydrogène --> H2O (réduit)
SOURCES:
- Chemistry-software.com. http://www.netsci-journal.com/97v4/97014/vitc2.html. Utilisé le 23.01.14
- DURUPTHY André, Chimie 1reS, Hachette Education, 2005
Destruction de la vitamine C à la lumière et en fonction du temps
L'acide ascorbique est assez sensible à la lumière. Après de nombreuses recherches, nous n'avons pas réussi à identifier le nom exact de la réaction chimique qui a lieu lorsque la vitamine C se retrouve à la lumière. Malgré tout, nos connaissances personnelles nous ont permis d'affirmer qu'une longueur d'onde assez grande telle que les UV permet de casser des liaisons dans une molécule. Il s'agit d'une réaction photochimique. Nous n'avons malheureusement pas réussi à trouver précisément quelles longueurs d'ondes sont nécessaires à la destruction des liaisons de la molécule d'acide ascorbique.
Quant au temps, il est clair que lorsque nous laissons le jus d'orange, dans une armoire ou même dans un réfrigérateur, la perte de vitamine C augmente en fonction du temps. Plus le temps de stockage est long, plus la perte est importante. En revanche, à notre niveau, nous ne pouvons expliquer la réaction chimique qui lie le temps et la destruction des molécules d'acide ascorbique.
Quant au temps, il est clair que lorsque nous laissons le jus d'orange, dans une armoire ou même dans un réfrigérateur, la perte de vitamine C augmente en fonction du temps. Plus le temps de stockage est long, plus la perte est importante. En revanche, à notre niveau, nous ne pouvons expliquer la réaction chimique qui lie le temps et la destruction des molécules d'acide ascorbique.
Notre conclusion
Le jus d'orange étant une boisson riche en vitamine C, nous avons donc tout intérêt à le conserver dans les meilleures conditions possibles afin d'en garder les bienfaits nécessaires à notre corps. Comme nous avons pu le constater pendant notre travail de recherche, la vitamine C se dégrade avec le temps, ainsi qu'en présence de lumière et de dioxygène. Cela est causé par des réactions chimiques, comme par exemple l'oxydation et les réactions photochimiques.
La lumière, le dioxygène et le temps sont les 3 principaux facteurs qui dégradent la vitamine C. En les assemblant cet effet devient encore plus conséquent. Lorsque le matin, vous ouvrez votre jus d'orange pour le petit déjeuner, les vitamines C commencent déjà à se dégrader par oxydation, et le lendemain quand vous buvez votre deuxième verre de jus d'orange il y a légèrement moins de vitamines que la veille. Si en plus vous avez acheté le jus quelques semaines auparavant, il y a une perte assez importante de vitamines même avant que vous l'ayez ouvert. Si vous ne faites pas attention et que vous laissez votre verre de jus d'orange sur la table avant de partir pour la journée, quand vous rentrez chez vous, la perte de vitamines est encore plus importante.
Nous pouvons donc conclure que pour exploiter le plus possible les vitamines C présentent dans un jus d'orange il est indispensable de le consommer rapidement après l'avoir acheté et surtout après l'ouverture. Vous pouvez gagner en taux de vitamine C en achetant des jus dont la date de péremption est la plus lointaine possible et en évitant de les conserver trop longtemps.
Cependant, il y a aussi une grande perte de vitamine C pendant sa fabrication, c'est à dire avant que les jus ne soient mis en vente dans les rayons d'un supermarché. Pour vraiment gagner le maximum de vitamine C, il faut donc mieux boire du jus fait avec des oranges fraîchement pressées.
La lumière, le dioxygène et le temps sont les 3 principaux facteurs qui dégradent la vitamine C. En les assemblant cet effet devient encore plus conséquent. Lorsque le matin, vous ouvrez votre jus d'orange pour le petit déjeuner, les vitamines C commencent déjà à se dégrader par oxydation, et le lendemain quand vous buvez votre deuxième verre de jus d'orange il y a légèrement moins de vitamines que la veille. Si en plus vous avez acheté le jus quelques semaines auparavant, il y a une perte assez importante de vitamines même avant que vous l'ayez ouvert. Si vous ne faites pas attention et que vous laissez votre verre de jus d'orange sur la table avant de partir pour la journée, quand vous rentrez chez vous, la perte de vitamines est encore plus importante.
Nous pouvons donc conclure que pour exploiter le plus possible les vitamines C présentent dans un jus d'orange il est indispensable de le consommer rapidement après l'avoir acheté et surtout après l'ouverture. Vous pouvez gagner en taux de vitamine C en achetant des jus dont la date de péremption est la plus lointaine possible et en évitant de les conserver trop longtemps.
Cependant, il y a aussi une grande perte de vitamine C pendant sa fabrication, c'est à dire avant que les jus ne soient mis en vente dans les rayons d'un supermarché. Pour vraiment gagner le maximum de vitamine C, il faut donc mieux boire du jus fait avec des oranges fraîchement pressées.
 |
| Photo prise avant le tournage d'une de nos vidéos, et aussi après deux heures de sport d'où l'extrème fatigue de notre scientifique |
Bibliographie
SITES INTERNET:
- Bosceawy. http://www.cc-bosceawy.fr/download/fiche2_il_etait_une_fois_la_brique_alimentaire.pdf (découvrir composition d'une brique de jus d'orange). Utilisé le 17 octobre 2013.
- ConsoGlobe. http://www.planetoscope.com/boisson/201-consommation-mondiale-de-jus-d-orange.html. Utilisé le 3 novembre 2013.
- Académie Bordeaux. http://machimelec.free.fr/FMB/TP_fichiers/CHIMIE-I/CI.b_ExAO_dosage-pHmetrique-vitamineC.pdf (principe du dosage de l'acide ascorbique). Utilisé le 7 novembre 2013.
- Académie de Bordeaux. http://webetab.ac-bordeaux.fr/Etablissement/LJay/pedagogie/disciplines/phychi/Lesdosagesacidobasiques.pdf (protocole des deux expériences de dosage acido-basique). Utilisé le 7 novembre 2013.
- Dico-vitamines.com. http://dico-vitamines.com/vitamines-hydrosolubles/la-vitamine-c-acide-ascorbique/. Utilisé le 23 janvier 2014.
- Chemistry-software.com. http://www.netsci-journal.com/97v4/97014/vitc2.html. Utilisé le 23.01.14
- Roles des constituants alimentaires. http://www.roles-des-constituants-alimentaires.fr/index.php?option=com_content&view=article&id=10&Itemid=13.Utilisé le 30 janvier 2014.
- Réactions de brunissement. http://biochim-agro.univ-lille1.fr/brunissement/co/ch1_III.html. Utilisé le 30 janvier 2014.
- Wikipedia. http://en.wikipedia.org/wiki/Redox. Utilisé le 30 janvier 2014.
- Hélène Gale Paris. http://helene-gale.com/fr/encyclopedie/vitamine_c_acide_ascorbique2.php. Utilisé le 5 février 2014.
- Nutrition-expertise. http://www.nutrition-expertise.fr/vitamines/vitamine-c.html et http://www.nutrition-expertise.fr/vitamines/vitamine-c/293-allegations-efsa.html Utilisés le 6 février 2014.
- Caducee.net. http://www.caducee.net/Fiches-techniques/vitamineC-1.asp Utilisé le 6 février 2014.
LIVRES:
- Cours et TP de physique de Première S (pour la dilution)
- Cours et livre de physique de Terminal S (pour le dosage ph-métrique)
- DURUPTHY André, Chimie 1reS, Hachette Education, 2005
Inscription à :
Articles (Atom)